1. はじめに
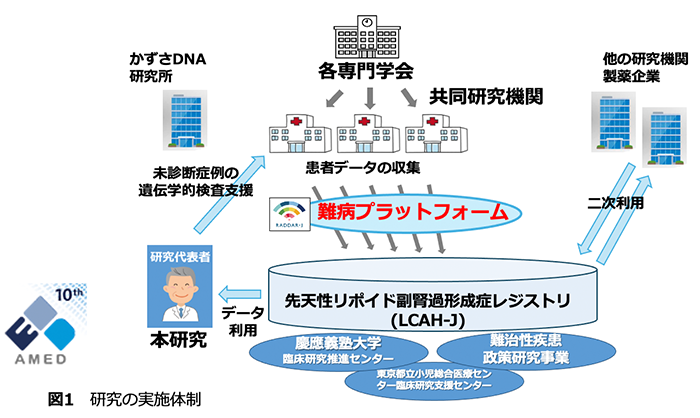
AMED難治性疾患実用化研究事業LCAH研究班が主体となって行っている先天性リポイド副腎過形成症の患者様を対象とした臨床研究です(図1)。
この研究は、東京都立小児総合医療センターの倫理審査委員会で倫理的観点および科学的観点からその妥当性について審査を受け、倫理審査委員会の承認のもと、各施設の許可を受けて実施しています。
この研究は大学病院医療情報ネットワーク(UMIN)センターが運営する臨床試験登録システムに登録されています(UMIN臨床試験ID:UMIN000050445 )。
2. 目的
この研究は、より多くの先天性リポイド副腎過形成症の患者さんの経過や診療内容などのデータを継続的かつ長期的に収集し、この体質に特有の合併症を予測し回避すること、治療を最適化することを主な目的としています。
3. 意義
この研究を進めることで、将来的に次のことが実現する可能性があります。
1)研究の進展・迅速化
より多くの患者さんの臨床情報を収集し、医療従事者や研究者が共有することで、これまで分からなかった疾患の理解が進み、それが今後の症状の予測や合併症の回避、現在の治療の最適化や新しい治療法や薬の開発につながる可能性があります。
2)臨床試験・治験に参加する機会が増える可能性
現在、世界中で個人の体質に合った診療方針の研究が進んでいます。「先天性リポイド副腎過形成症」の患者レジストリ(患者さんのデータベース)に登録することで、個人に合った検査法や治療法の開発に関わる機会が増える可能性があります。
3)疾患の最新情報の入手
先天性リポイド副腎過形成症のレジストリ研究は、小児内分泌科医、内科内分泌科医、泌尿科医、産婦人科医、疫学専門医などの専門家集団により行われます。この体質に関する最新情報が国内外から集まりますので、この研究に参加することで、医療機関などからこの体質に関する最新情報を受取りやすくなる可能性があります。
4. 方法
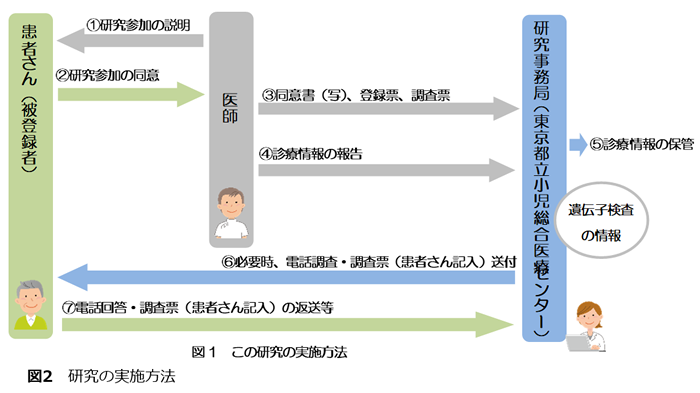
(1)実施方法(図2)
この研究では、担当医師が通常の診療から判明する患者様の症状や検査結果などの「臨床情報」を難病プラットフォーム*上のシステムを通して6か月ごとに定期的に提供いただきます
* 難病プラットフォーム とは、日本医療研究開発機構(AMED)および厚生労働省の指定難病の研究班が収集した臨床情報や生体試料から得られた情報を集約する、セキュリティが十分に確保された情報統合基盤で公的なデータベースの一つです。
(2)協力事項
臨床情報を定期的に過不足なく収集することが、質の高い研究につながります。担当医師に限らず、研究事務局の担当者が電話や調査票(患者さん記入)等を用いて直接患者様にご連絡することがあります。
以下に挙げた臨床情報をご提供いただきます。
標準項目:氏名、連絡先、生年月日、性別、人種、出生情報、診断名、指定難病患者の認定の有無、発症年月、診断年月、診療医療機関名、診療科、生活の質調査票(EQ-5D-5L)、転帰準標準項目:最終学歴、既往歴、生活状況、嗜好品、遺伝学的検査、家族歴、妊娠・出産情報、合併症、両親情報、出生時情報
追加項目:身体所見(身長、体重、腹囲、血圧など)、臨床検査(血液家生化学検査、内分泌学的検査)、スポット尿検査、精液検査、性腺超音波検査、骨密度検査、治療状況(治療薬、投与量)、SF36による生活の質調査*
* SF36による生活の質調査
18歳以上の患者様を対象とします。患者様毎にQRコードをお伝えし、6か月毎にご自宅で入力していただきます。
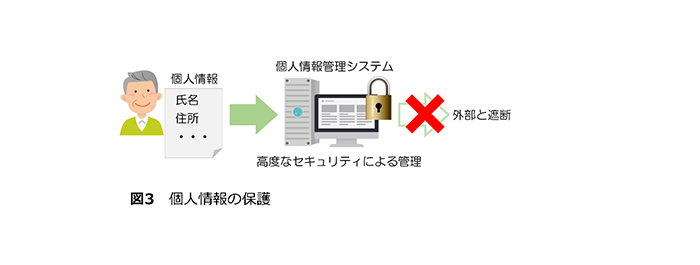
(3)個人情報等の取り扱い(図3)
この研究では、氏名、電話番号など個人を特定し得る情報を収集します。これらの情報は暗号化され、他の臨床情報が登録されているサーバーとは別のより強固な複数のサーバー(個人情報管理システム)に分散して保存されます。このため万が一機器が持ち出されたり、サーバーへの外部からの侵入があったりしたとしても、患者様を特定することができる情報を抜き出すことは極めて困難です。
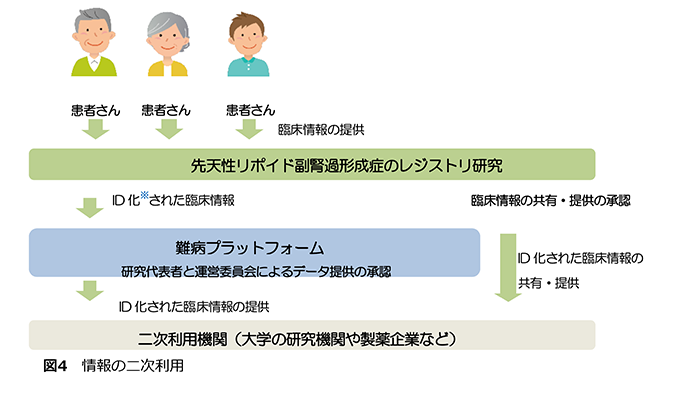
(4)情報の二次利用(図4)
この研究への参加に同意いただくと、難病プラットフォームへの臨床情報の共有や提供についても同意いただいたことになります。本研究も難病プラットフォームと連携していて、IDで管理された患者様の臨床情報は、最終的に他の疾患のレジストリ研究の患者様のデータとともに、難病プラットフォームに共有されます。
提供された臨床情報は国内外の他の研究機関(二次利用機関といいます)と共有されることがあります。臨床情報を二次利用機関へ提供する際は、提供先の研究計画が科学的・倫理的に妥当な内容か、患者様に不利益がないか、医学研究に関する倫理指針を遵守した内容であるかについて、本研究の研究代表者の承認を得た上で、難病プラットフォームの運営委員会で審査し、そこで認められた二次利用機関のみが、臨床情報を利用することができます。二次利用機関は、承認された範囲を超えて臨床情報を利用することは禁じられています。また、個人を特定し得る情報は二次利用機関には提供されません。
5. 研究に参加される方の利益と
不利益
(1)この研究への参加による利益
ご自身や他の患者様の予後の予測、合併症の回避、治療の最適化などに役立つ可能性があります。
この体質に関する新しく判明した病態や治療などの最新情報を受取りやすくなる可能性があります。臨床試験・治験に参加する機会が増える可能性があります。
研究参加者に対して協力の謝品としてQUOカード2000円分をお渡ししています。
(2)この研究への参加による不利益
この研究へ参加することで新たに生じる身体・精神の負担はありません。
臨床情報は通常の診療範囲内でご提供いただきますので、保険診療の負担分(通常の外来受診料)以外に新たに発生する費用負担はありません。
6. 研究体制
以下の施設で研究を進めています。
東京都立小児総合医療センター、慶應義塾大学、京都大学、大分大学、福島県立医科大学、徳島大学、浜松医科大学、大阪母子医療センター、聖マリアンナ医科大学横浜市西部病院、新潟大学医歯学総合病院、あいち小児保健医療総合センター、太田記念病院、医誠会国際総合病院、名古屋市立大学病院、国立成育医療研究センター、さいたま市立病院、九州大学病院、静岡市立清水病院、金沢大学、東京歯科大学市川総合病院、信州大学、自治医科大学とちぎこども医療センター、東京女子医科大学、兵庫県立こども病院、北海道大学、静岡赤十字病院、一宮市立市民病院、富山大学、東京都立多摩北部医療センター、国立病院機構金沢医療センター、豊橋市民病院、山形大学医学部附属病院、北里大学病院、産業医科大学、東京大学など
7. 問い合わせ先
本研究の内容についてご心配なことなどありましたら、遠慮なくお問い合わせください。トップページの「お問い合わせリンク」 をご利用ください。
8. 臨床研究へのご協力をお願いします